Alter und CAG-Länge in der HD-Datenanalyse
Wie Alter und CAG bei der statistischen Analyse von Huntington-Daten berücksichtigt werden.
Hintergrund
Die Huntington-Krankheit entwickelt sich im Laufe der Zeit, wobei die Anzeichen und Symptome typischerweise in der Lebensmitte auftreten (Ross et al. 2014). Der Zeitpunkt der Anzeichen und Symptome der Huntington-Krankheit hängt stark von der CAG-Länge ab (Abbildung 1), wobei längere Längen mit einem jüngeren Erkrankungsalter verbunden sind (Lee et al. 2012). Folglich, Alter Und CAG-Länge sind wichtige Überlegungen bei fast jeder Huntington-Analyse. In diesem Artikel werden mehrere alters- und CAG-bezogene Probleme erörtert, die ein Forscher berücksichtigen sollte, bevor er mit der Analyse von Beobachtungsdatensätzen der Huntington-Krankheit wie Enroll-HD beginnt (Landwehrmeyer et al. 2016).
Die Beziehung zwischen Alter und CAG wird in fast allen Huntington-Analysen berücksichtigt, aber die Details, wie Alter und CAG sind behandelt in statistischen Modellen hängt vom Kontext ab. Dabei konzentrieren wir uns auf die Kontexte einer Querschnittsanalyse und einer Längsschnittanalyse.
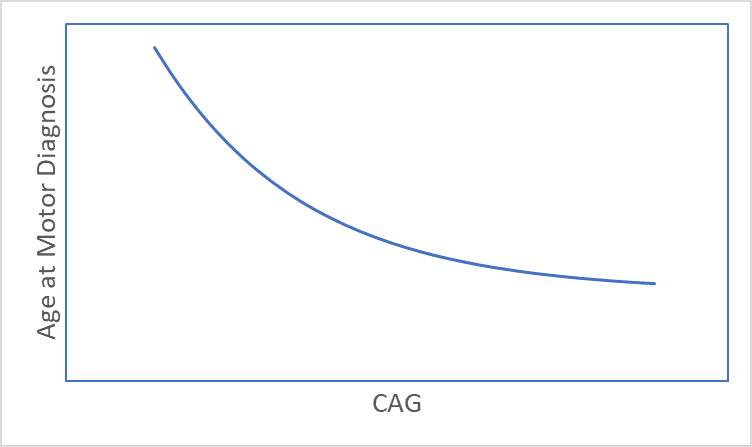
Abbildung 1. Der Zusammenhang zwischen CAG-Länge und Alter bei der motorischen Diagnose.
Querschnittsanalyse
Bei der Querschnittsanalyse werden Variablen verwendet, die zu einem einzelnen Zeitpunkt oder Besuch erfasst werden. Ein häufig verwendeter einzelner Zeitpunkt ist der Besuch bei Studienbeginn (dh der Basisbesuch).
Wenn es mehrere Zeitpunkte pro Teilnehmer gibt, wie in der Enroll-HD-Datenbank, werden alle Besuche außer dem Besuch zum ausgewählten Zeitpunkt ignoriert. Auch wenn einige Daten nicht verwendet werden, bietet eine Querschnittsanalyse einen Gewinn an Einfachheit. Die meisten statistischen Standardmethoden, wie beispielsweise die konventionelle multiple Regression, sind für die Querschnittsanalyse gedacht.
Durch die Fokussierung auf einen einzelnen Zeitpunkt, beispielsweise den Studieneintritt, wird das Problem eines Studienabbruchs im Laufe der Zeit vermieden, was oft bedeutet, dass die Analyse die Anzahl der Beobachtungen (Teilnehmer) maximiert. Eine Querschnittsanalyse eignet sich auch zur Untersuchung langfristiger Auswirkungen der Huntington-Krankheit (abhängig von den Merkmalen der Studienprobe). Das Fortschreiten der Huntington-Krankheit ist relativ langsam, mit durchschnittlich 15 Jahren vom motorischen Einsetzen bis zum Tod (Keum et al. 2017), daher ist die Zeit, die für HDGECs bis zum Eintritt in die Studie vergeht, oft viel länger als die Zeit, in der die Menschen in der Studie beobachtet werden. Dies bedeutet, dass Informationen über den langfristigen Verlauf oft aus Variablen gewonnen werden, die bei Studienbeginn gemessen wurden, und weniger aus der kurzfristigen Veränderung innerhalb der Studie.
Aktuelle Forschungsergebnisse legen nahe, dass die CAG-Wiederholungslänge dynamisch ist, sich auf Zellebene weiter ausdehnt und schließlich einen Mechanismus auslöst, der zum Zelltod führt (Hong et al. 2020). Hierzu sind Querschnittstudien wichtig somatische Expansion denn der einzige Vergleich, der gemacht werden muss, ist zwischen Bei solchen Vergleichen müssen Unterschiede im Ausmaß und in der Dauer der Exposition gegenüber toxischen Wirkungen von mHTT berücksichtigt werden. Menschen nehmen an einer Studie mit unterschiedlichen Expositionszeiten teil, die nach dem Alter bei Eintritt indiziert sind, und mit unterschiedlichen Krankheitsausprägungen, die durch die vererbte CAG-Länge indiziert sind. Es ist von entscheidender Bedeutung, diese Unterschiede zwischen den Menschen zu berücksichtigen, um Verzerrungen zu vermeiden und gleiche Ausgangsbedingungen für den Vergleich der gewählten Variablen zu schaffen.
Ein gemeinsames Ziel einer Querschnittsanalyse besteht darin, zu untersuchen, inwieweit eine Variable mit dem Krankheitsverlauf zusammenhängt. Beispielsweise wird bei der Suche nach neuen Flüssigkeitsbiomarkern (z. B. einer im Liquor gemessenen Substanz) häufig untersucht, wie sich die Konzentrationen eines Biomarkers je nach Alter und CAG-Länge bei Studienbeginn unterscheiden (Leoni et al. 2013). Alter und CAG-Länge dienen als Fortschrittsindikatoren und fließen auf verschiedene Weise in die statistischen Modelle ein. Das Zusammenspiel von Alter und CAG-Länge ist wichtig für die Indexierung der Progression (Langbehn, Hayden und Paulsen 2010), und daher ist der Produktbegriff –DECKEL– wird häufig als Prädiktor (wie bei einer multiplen Regression) zusammen mit den Haupteffekten (einzelnen Variablen) eingegeben.
CAG-Age-Produkt (CAP)
Um die Modellierung zu vereinfachen, wurde der kombinierte Effekt von Alter und CAG im erfasst CAG-Age-Produkt (CAP) (Penney et al. 1997; Langbehn, Hayden und Paulsen 2010; Zhang et al. 2011). CAP hat die allgemeine Form von CAP = (Alter bei Studieneintritt) ⋅ (CAG – L) / K, Wo L ist eine Zentrierkonstante und K ist eine Skalierungskonstante.
Basierend auf der umfassenden Analyse von Warner et al. (2020) hat die bevorzugte GAP L = 30 Und K = 6,49, Geben CAP = (Alter bei Studieneintritt) ⋅ (CAG-30) / 6,49. Diese Formel ist so standardisiert, dass CAP = 100 im erwarteten Diagnosealter ist. Allerdings wurden und werden in verschiedenen Analysen unterschiedliche Konstant- und Skalierungswerte verwendet. Insbesondere wurde CAP mit der PREDICT-HD-Datenbank von Zhang et al. entwickelt. (2011) verwendet L = 33,66 Und K = 1, so dass CAP = (Alter bei Studieneintritt) ⋅ (CAG – 33,66). Die von Penney et al. entwickelte CAP. Verwendet L = 35,5 Und K = 1, so dass CAP = (Alter bei Studieneintritt) ⋅ (CAG – 35,5).
Der Vorteil von CAP besteht darin, dass es sich um einen einzelnen Progressionsscore handelt und dieser als Prädiktor in ein multiples Regressionsmodell zusammen mit Anpassungsvariablen wie dem Geschlecht einbezogen werden kann, deren Kontrolle der Analyst für wichtig hält. Beispielsweise könnte ein Analyst den Regressionskoeffizienten von CAP schätzen, der einen Flüssigkeitsbiomarker vorhersagt, der das Geschlecht kontrolliert. Ein signifikanter CAP-Koeffizient in diesem Beispiel deutet auf eine statistisch zuverlässige Beziehung zwischen der Progression und dem Biomarker hin, der sich an die Geschlechterzugehörigkeit anpasst.
Die Verwendung von CAP als kontinuierliche Bewertung im obigen Beispiel ist nur anwendbar, wenn die Teilnehmer über einen erweiterten CAG-Trakt verfügen (hauptsächlich 40 oder mehr Wiederholungen). CAP ist für Personen im normalen CAG-Wiederholungsbereich irrelevant und nicht definiert. Dennoch gibt es mehrere veröffentlichte Analysen der Huntington-Krankheit, in denen Personen mit einem erweiterten CAG mit denen verglichen werden, bei denen dies nicht der Fall ist (z. B. nicht betroffene Familienmitglieder oder Kontrollpersonen in der Gemeinschaft). Ein Grund für diesen Vergleich besteht darin, den Zeitpunkt früher Anzeichen und Symptome der Huntington-Krankheit zu bestimmen (Paulsen et al. 2014; Tabrizi et al. 2013).
Aufgrund der Krankheitsdauer können manifeste Personen in CAP-Score-Kategorien eingeteilt werden, die das frühe, mittlere und späte Krankheitsstadium widerspiegeln.
Beispielsweise verwenden Zhang et al. (2011) die folgenden Schwellenwerte, um Krankheitsstadien mithilfe ihrer CAP-Version zu kategorisieren: Früh = 367.
Bei Verwendung des bevorzugten Warner et al. (2020) GAP (L = 30, K = 6,49) Der Analyst kann die Quartile für die Enroll-HD-Verteilung für vollständig durchdringende Teilnehmer verwenden (CAG ≥ 40), das sind die 25Th und 75Th Perzentile von 88 und 119 (Enroll-HD PDS4; Release v2018-10-R3). Daher würden die Gruppen als <88, 88-119, >119 definiert. Es müssen zusätzliche Arbeiten durchgeführt werden, um optimale Schnittpunkte festzulegen.
Längsschnittanalyse
Die meisten Huntington-Beobachtungsdatenbanken haben wiederholte Besuche für mindestens einen Teil der Teilnehmer; Die Verfügbarkeit von Längsschnittdaten in Enroll-HD wird veranschaulicht (Abbildung 2). Wenn dieselbe Person im Laufe der Zeit bei wiederkehrenden Besuchen gemessen wird, bezeichnen wir ihre Daten als Längsschnitt.
Die Längsschnittanalyse hat gegenüber der Querschnittsanalyse den entscheidenden Vorteil, dass sie untersucht, wie sich Prozesse im Laufe der Zeit auf teilnehmerinterner Basis entwickeln. Die typische Querschnittsanalyse ist hinsichtlich der Progression retrospektiv, da sie nur auf die Ergebnisse der Progression bis zum interessierenden Zeitpunkt (z. B. Studieneintritt) schließen kann. Eine Längsschnittanalyse ist prospektiv, da wir den Verlauf im Laufe der Zeit untersuchen können. Längsschnittdaten gelten als entscheidend für die Bereitstellung von Beweisen zur Unterstützung von Ursache und Wirkung, weshalb zulassungsrelevante klinische Studien ihrer Natur nach längsschnittlich sind (siehe „Verwendung von Beobachtungsdaten zur Information über das Design klinischer Studien” für weitere Informationen). Darüber hinaus schließt eine Längsschnittanalyse eine Querschnittsanalyse ein, da der erste Besuch im Längsverlauf der Besuch bei Studieneintritt ist. Daher stehen alle Ergebnisse der Querschnittsanalyse sowie die einzigartigen prospektiven Ergebnisse der Längsschnittanalyse zur Verfügung.
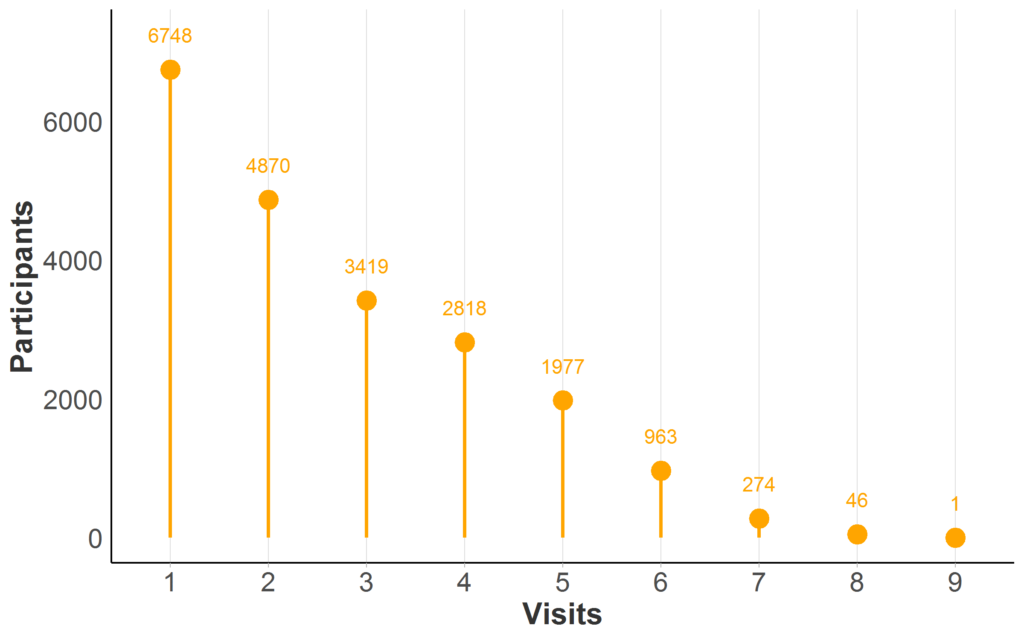
Abbildung 2. Längsschnittdatenverfügbarkeit in Enroll-HD PDS5 (Veröffentlichung 2020-10-R1). Teilnehmerzählung nach maximaler Anzahl von Enroll-HD-Besuchen (nur Basis- und Folgebesuche; außerplanmäßige Besuche und Telefonkontakte ausgenommen). Vollständige Stichprobe dargestellt (N = 21.116; fehlendes N = 0).
In der Huntington-Forschung wurde die Längsschnittanalyse verwendet, um den natürlichen Krankheitsverlauf zu beschreiben, insbesondere das Muster (oder die Entwicklung) wichtiger klinischer Variablen im Zeitverlauf (Langbehn et al. 2019; Long et al. 2014; Paulsen, Smith und Long 2013). Die Längsschnittanalyse wurde auch verwendet, um den Zeitpunkt von Meilensteinereignissen zu untersuchen, beispielsweise das Alter bei der motorischen Diagnose für verschiedene CAG-Erweiterungen (Long und Mills 2018).
Mit den zusätzlichen prospektiven Erkenntnissen einer Längsschnittanalyse geht auch die Komplexität einher. Wiederholte Beobachtungen derselben Person werden korreliert, und die Anzahl der Beobachtungen variiert da die Personen zu unterschiedlichen Zeitpunkten in die Studie eintreten (länger zurückliegender oder erst kürzlich erfolgter Einschluss). Diese Merkmale müssen mit fortschrittlichen statistischen Methoden berücksichtigt werden, beispielsweise linearen gemischten Modellen für Längsschnittdaten (Verbeke und Molenberghs 2009).
Ähnlich wie eine Querschnittsanalyse kann eine Längsschnittanalyse kontinuierliche CAP oder CAP-Gruppen verwenden. Beispielsweise möchte ein Analytiker möglicherweise untersuchen, wie sich ein Flüssigkeitsbiomarker im Laufe der Zeit auf der Grundlage des CAP bei Studienbeginn verändert. Die retrospektiven Querschnittsinformationen zum Biomarker und zum Verlauf können mit einer Intercept-Analyse (Startpunktanalyse) untersucht werden, die sich auf den ersten Besuch bei Studieneintritt konzentriert. Darüber hinaus können mit einer Steigungsanalyse (Veränderungsanalyse), die sich auf die Veränderung über die wiederholten Besuche konzentriert, prospektive Informationen über den Biomarker und den Verlauf gewonnen werden.
Die Auswahl einer Zeitmetrik in der Längsschnittanalyse ist wichtig. Verschiedene Studien haben gezeigt, dass der Verlauf vieler klinischer Variablen der Huntington-Krankheit über die gesamte Lebensspanne eines Erwachsenen nicht linear ist. Abbildung 3 zeigt ein Beispiel für das über die Zeit verfolgte zusammengesetzte UHDRS (cUHDRS). Als weiteres Beispiel beginnen die mittleren motorischen Zeichen einer Kohorte mit CAG = 42 bei oder sehr nahe bei 0 (normal), wenn die Menschen Anfang 20 sind, nehmen dann in den nächsten Jahren leicht zu und steigen dann kurz vor der motorischen Diagnose stark an (Langbehn et al. 2019; Long et al. 2014; Paulsen et al. 2014). Wenn das Alter als Zeitmetrik verwendet wird, sollten Methoden zum Umgang mit nichtlinearen Trajektorien verwendet werden, wie beispielsweise Polynome des Alters (Long und Ryoo 2010) oder Spline-Terme (Long und Mills 2018).
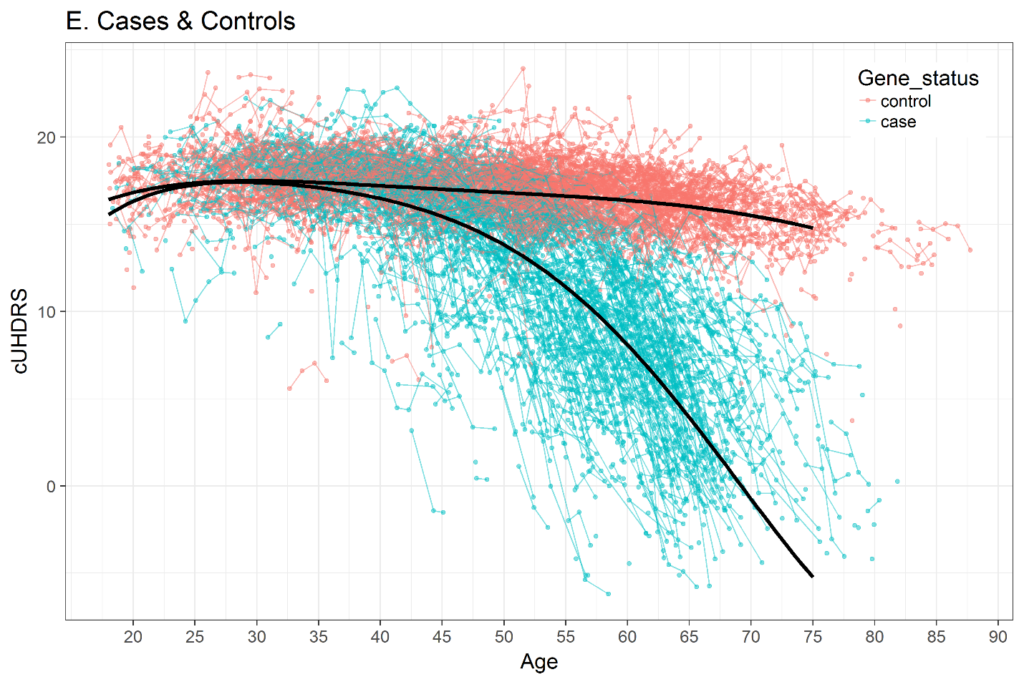
Figur 3. Veränderung der zusammengesetzten UHDRS-Werte (cUHDRS) im Laufe der Zeit bei HDGECs und gesunden Kontrollpersonen. Daten abgeleitet von Enroll-HD PDS4; Veröffentlichung v2018-10-R3.
Wenn Veränderungen für CAP oder CAP-Gruppen untersucht werden, reicht es interessanterweise oft aus, ein lineares Modell zu verwenden. Denken Sie daran, dass die frühen, mittleren und späten CAP-Gruppen den CAP-Bereich unterteilen. Innerhalb jeder GAP-Partition ist die Veränderung über einige Jahre hinweg relativ linear. Daher kann jede CAP-Gruppe als lineares Teil behandelt werden, und wenn alle Teile nebeneinander verkettet werden, ist die Änderung über alle Stufen nichtlinear, die Änderung innerhalb einer Stufe jedoch linear.
Bei Längsschnittanalysen mit CAP oder CAP-Gruppen wird empfohlen, die Zeit seit Studieneintritt (in Jahren oder Monaten) als Zeitmetrik zu verwenden. Zeitpunkt 0 ist der Besuch bei Eintritt, der anerkennt, dass CAP den Fortschritt bis zum Studieneintritt berücksichtigt. Bei der in der Längsschnittanalyse untersuchten Progression handelt es sich lediglich um die während der Studie beobachtete Progression und nicht um eine Progression seit der Geburt.
Schließlich beruht die Analyse des Zeitpunkts von Meilensteinereignissen häufig auf der Verwendung einer bestimmten Untergruppe von Teilnehmern, beispielsweise einer Untergruppe, die noch keine motorische Diagnose erhalten hat. Die Überlebensanalyse wird häufig verwendet, um zu untersuchen, ob die Dauer vom Studieneintritt bis zu einem bahnbrechenden Ereignis wie einer motorischen Diagnose durch CAP oder andere bei Studieneintritt gemessene Variablen vorhergesagt werden kann (Long und Paulsen 2015; Long et al. 2017).
Die Variableninformationen, die in einer Überlebensanalyse verwendet werden, sind der Zeitpunkt des Ereignisses oder der letzte aufgezeichnete Zeitpunkt in der Studie für diejenigen, die das Ereignis nicht erleben, und die Prädiktorvariable bei Studienbeginn. Obwohl bei allen Besuchen alle Kernvariablen erfasst werden, werden die zusätzlichen Informationen häufig nicht genutzt. Darüber hinaus werden Teilnehmer, bei denen das interessante Ereignis (z. B. eine motorische Diagnose) bereits vor der Aufnahme in die Studie stattgefunden hat, in der Regel von der Analyse ausgeschlossen. Eine solche Filterung kann gerechtfertigt sein, wenn Personen und/oder Beobachtungen nach dem Zufallsprinzip ausgeschlossen werden, sodass die verbleibenden Informationen repräsentativ für die ausgelassenen Informationen sind. Es gibt jedoch Szenarien, in denen die Filterung zu einer Verzerrung der Ergebnisse führen kann. Statistische Methoden zur Maximierung der Nutzung aller verfügbaren Daten werden weiterhin entwickelt (siehe Long und Mills 2018), und der Analyst wird ermutigt, über die Auswirkungen einer Filterung der Datenbank nachzudenken.
Verweise
Hong, PE, ME MacDonald, VC Wheeler, L. Jones, P. Holmans, M. Orth, DG Monckton, et al. 2020. „Pathogenese der Huntington-Krankheit: Zwei aufeinanderfolgende Komponenten.“ Zeitschrift für Huntington-Krankheit.
Keum, JW, A. Shin, T. Gillis, JS Mysore, KA Elneel, D. Lucente, T. Hadzi, et al. 2017. „Die HTT-Cag-Expansion-Mutation bestimmt das Sterbealter, nicht aber die Krankheitsdauer bei der Huntington-Krankheit.“ Das American Journal of Human Genetics 98: 287–98.
Landwehrmeyer, BG, C. Fitter-Attas, J. Giuliano und et al. 2016. „Datenanalyse von Enroll-HD, einer globalen klinischen Forschungsplattform für die Huntington-Krankheit.“ Klinische Praxis für Bewegungsstörungen 4: 212–24.
Langbehn, DR, MR Hayden und JS Paulsen. 2010. „CAG-Wiederholungslänge und das Erkrankungsalter bei der Huntington-Krankheit (HD), eine Überprüfungs- und Validierungsstudie statistischer Ansätze.“ American Journal of Medical Genetics, Teil B 153: 397–408.
Langbehn, DR, JC Stout, S. Gregory, JA Mills, A. Durr, BR Leavitt, RAC Roos, et al. 2019. „Zusammenhang von CAG-Wiederholungen mit langfristigem Fortschreiten der Huntington-Krankheit.“ JAMA Neurologie 76: 1375–85.
Lee, JM, EM Ramos, JH Lee, T. Gillis, JS Mysore, MR Hayden, SC Warby, et al. 2012. „Die CAG-Wiederholungsexpansion bei der Huntington-Krankheit bestimmt das Alter bei Ausbruch auf völlig dominante Weise.“ Neurologie 78: 690–95.
Leoni, V., JD Long, JA Mills, S. Di Donato und JS Paulsen. 2013. „Korrelation von 24S-Hydroxycholesterin im Plasma mit Markern für das Fortschreiten der Huntington-Krankheit.“ Neurobiologie der Krankheit 55: 37–43.
Long, JD und JA Mills. 2018. „Gemeinsame Modellierung multivariater Längsschnittdaten und Überlebensdaten in mehreren Beobachtungsstudien zur Huntington-Krankheit.“ Medizinische Forschungsmethodik 18: 138–53.
Long, JD, JA Mills, BR Leavitt, A. Durr, RA Roos, JC Stout, R. Reilmann, et al. 2017. „Überlebensendpunkte für Studien zur Huntington-Krankheit vor einer motorischen Diagnose.“ JAMA Neurologie 74: 1–9.
Long, JD und JS Paulsen. 2015. „Multivariate Vorhersage der motorischen Diagnose bei der Huntington-Krankheit: 12 Jahre PREDICT-HD.“ Bewegungsstörungen 12: 1664–72.
Long, JD, JS Paulsen, K. Marder, Y. Zhang, J. Kim und JA Mills. 2014. „Verfolgung motorischer Beeinträchtigungen im Verlauf der Huntington-Krankheit.“ Bewegungsstörungen 29: 311–19.
Long, JD und J. Ryoo. 2010. „Verwendung gebrochener Polynome zur Modellierung nichtlinearer Trends in Längsschnittdaten.“ British Journal of Mathematical and Statistical Psychology 63: 177–203.
Paulsen, JS, JD Long, CA Ross, DL Harrington, CJ Erwin, JK Williams, HJ Westervelt, et al. 2014. „Vorhersage der manifesten Huntington-Krankheit mit klinischen und bildgebenden Maßnahmen: Eine prospektive Beobachtungsstudie.“ Lancet-Neurologie 13: 1193–1201.
Paulsen, JS, MM Smith und JD Long. 2013. „Kognitiver Rückgang der Auswirkungen der prodromalen Huntington-Krankheit auf klinische Studien.“ Zeitschrift für Neurologie, Neurochirurgie und Psychiatrie 84: 1233–9.
Penney, JB, JP Vonsattel, ME MacDonald, JF Gusella und RH Myers. 1997. „Die CAG-Wiederholungszahl regelt die Entwicklungsrate der Pathologie bei der Huntington-Krankheit.“ Annalen der Neurologie 41: 689–92.
Ross, CA, EH Aylward, EJ Wild, DR Langbehn, JD Long, JH Warner, RI Scahill, et al. 2014. „Naturgeschichte der Huntington-Krankheit, Biomarker und Aussichten für Therapeutika.“ Nature Reviews Neurologie 10: 204–16.
Tabrizi, SJ, RI Scahill, G. Owen, A. Durr, BR Leavitt, RA Roos, B. Borowsky, et al. 2013. „Prädiktoren für das phänotypische Fortschreiten und den Krankheitsausbruch bei der prämanifesten und frühen Huntington-Krankheit in der TRACK-HD-Studienanalyse von 36-monatigen Beobachtungsdaten.“ Lancet-Neurologie 12: 637–49.
Verbeke, G. und G. Molenberghs. 2009. Lineare gemischte Modelle für Längsschnittdaten. New York: Springer-Verlag.
Warner, JH, JD Long, JA Mills, DR Langbehn, J. Ware, A. Mohan und C. Sampaio. 2020. „Standardisierung des CAP-Scores bei der Huntington-Krankheit I: Vorhersage des Erkrankungsalters.“
Zhang, Y., JD Long, JA Mills, JH Warner, W. Lu und JS Paulsen. 2011. „Indexierung des Krankheitsverlaufs bei Studieneintritt bei Personen mit einem Risiko für die Huntington-Krankheit.“ American Journal of Medical Genetics Teil B Neuropsychiatrische Genetik 156: 751–63.